物質量 n の単原子分子の理想気体の状態を、図3のように変化させる。過程A→Bは定積変化、過程B→Cは等温変化、過程C→Aは定圧変化である。状態Aの温度を T0 、気体定数を R とする。
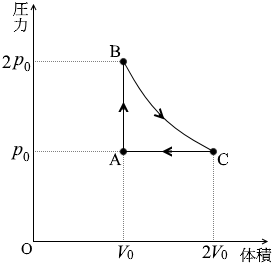
(問3)状態Aにおける気体の内部エネルギーは nRT0 の何倍か。
(問4)状態Bの温度は T0 の何倍か。
(問5)過程C→Aにおいて気体が放出する熱量は nRT0 の何倍か。
#センター17本試物理
物質量 n の単原子分子の理想気体の状態を、図3のように変化させる。過程A→Bは定積変化、過程B→Cは等温変化、過程C→Aは定圧変化である。状態Aの温度を T0 、気体定数を R とする。

(問3)状態Aにおける気体の内部エネルギーは nRT0 の何倍か。
(問4)状態Bの温度は T0 の何倍か。
(問5)過程C→Aにおいて気体が放出する熱量は nRT0 の何倍か。
#センター17本試物理
(問3)
物質量 n 、温度 T0 の単原子分子の理想気体の内部エネルギーは
\(\large{\frac{3}{2}}\)nRT0
よって、 \(\large{\frac{3}{2}}\) 倍。
(問4)
状態Bの温度を TB と置きますと、ボイル⋅シャルルの法則より、
\(\Big(\)\(\large{\frac{p_{\rm{A}}V_{\rm{A}}}{T_{\rm{A}}}}\) = \(\large{\frac{p_{\rm{B}}V_{\rm{B}}}{T_{\rm{B}}}}\)\(\Big)\)
⇔ \(\large{\frac{p_0V_0}{T_0}}\) = \(\large{\frac{2p_0V_0}{T_{\rm{B}}}}\)
∴ \(\large{\frac{1}{T_0}}\) = \(\large{\frac{2}{T_{\rm{B}}}}\)
∴ TB = 2T0
よって、 2 倍。
(問5)
『定圧モル比熱』で説明したことを繰り返します。過程C→Aにおいて外部から加えた熱量を Q' とします。
定圧変化においては、
Q' = ΔU + pΔV ……④
であり、気体が単原子分子であれば、
ΔU = \(\large{\frac{3}{2}}\)nRΔT ……⑤
であり、理想気体の状態方程式より、
pΔV = nRΔT ……⑥
であるので、⑤式⑥式を④式に代入すると、
Q' = \(\large{\frac{3}{2}}\)nRΔT + nRΔT
= \(\large{\frac{5}{2}}\)nRΔT ……❼
気体が放出する熱量を Q と置きますと、Q' = - Q であるので、上式は
- Q = \(\large{\frac{5}{2}}\)nRΔT
状態Aの温度を TA 、状態Cの温度を TC と置きますと、ΔT = TA - TC であるので、さらに上式は
- Q = \(\large{\frac{5}{2}}\)nR(TA - TC)
TA = T0 であり、過程B→Cは等温変化であるので TB = TC であり、TB = 2T0 であるので、さらにさらに上式は
- Q = \(\large{\frac{5}{2}}\)nR(T0 - 2T0)
∴ - Q = - \(\large{\frac{5}{2}}\)nRT0
∴ Q = \(\large{\frac{5}{2}}\)nRT0
よって、 \(\large{\frac{5}{2}}\) 倍。
正負がややこしくて分からなくなりがちですが、要は❼式で表される量の絶対値が放出されるということです。過程C→Aにおいては、温度が下がる(ΔU)だけでなく体積も減り(pΔV)、
ΔU = \(\large{\frac{3}{2}}\)nRΔT
pΔV = nRΔT
であるので、合わせて
\(\large{\frac{5}{2}}\)nRΔT
だけ減ることになり、本問では ΔT = T0 なので、減る量は
\(\large{\frac{5}{2}}\)nRT0
であり、この減った分が熱量として放出されるということです。